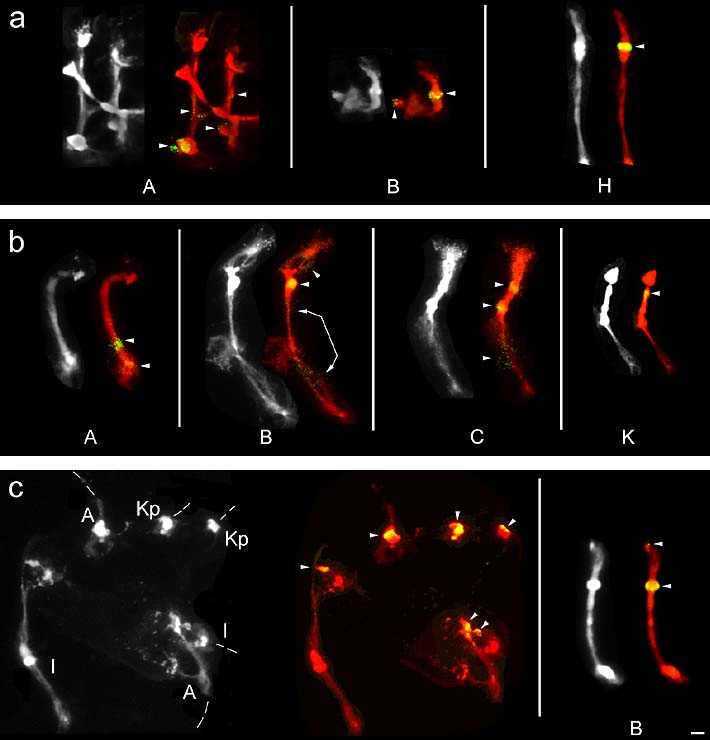





Die Signalstärke der Mikrosatelliten-Loci war zum Teil sehr unterschiedlich. Sie reichte von Ansammlungen aus nur wenigen Signalpunkten bis zu Anhäufungen, die einen Teil des centromerischen Heterochromatins auszufüllen schienen. Allgemein konnte man beobachten, daß ihr Auftreten um so unregelmäßiger war je schwächer die Signale waren. Es wurden daher nur Loci eines Mikrosatelliten-Motivs berücksichtigt, die sich regelmäßig nachweisen ließen. Für die Detektion der Mikrosatelliten-Loci wurde das Digoxigenin-Biotin-Amplifikations-System mit zwei bis drei Lagen Fluorochrom-gekoppeltem Avidin-FITC verwendet.
(AT)8
Das Motiv (AT)8 hybridisierte auf den Chromosomen A, B und H an insgesamt fünf Loci (Abbildung 14a). Auf Chromosom A kamen zwei Loci im Euchromatin des langen Armes vor, einmal im mittleren Segment an Position Aq21.2' und in dem etwas stärker kondensierten Euchromatinbereich bei Aq31. Auf Chromosom B ließen sich ebenfalls zwei Loci auf dem langen Arm beobachten. Das stärkere Signal befand sich an der Stelle der starken DAPI-Bande bei Bq21 und das schwächere Signal terminal (Bqter). Chromosom H trug ein starkes Signal an der Stelle der starken DAPI-Bande an der Position Hq21.
(AG)8
Die Hybridisierungen mit (AG)8 zeigte auf den vier Chromosomen A, B, C und K insgesamt neun Signale (Abbildung 14b). Auf Chromosom A ließen sich zwei Signale beobachten, eines im distalen Segment des Euchromatins bei Aq21.3' und das andere im Bereich des dichter gepackten Euchromatin bei Aq31. Auf Chromosom B wurden drei Loci festgestellt. Der Locus mit dem stärksten Signal lag an der Stelle der starken DAPI-Bande Bq21. Die beiden anderen, schwächeren Loci lagen jeweils etwa in der Mitte des euchromatischen Bereiches an den Position Bp21.2' und Bq31.2'. Chromosom C zeigte ebenfalls drei Loci von (AG)8. Einer davon befand sich im mittleren Segment des euchromatischen Teil des langen Arms bei Cq31.2'. Die beiden anderen lagen im cHC des langen Arms an den Positionen Cp12 und Cq21. Chromosom K wies nur einen Locus im cHC an Position Kq22-23 auf.
(CA)8
Bei Verwendung von (CA)8 als Sonde zeigten sich auf den drei NO-Chromosomen A, I und K sowie auf Chromosom B insgesamt acht Loci (Abbildung 14c). Die Signale auf den NO-Chromosomen A, I und K lagen jeweils in Bereichen des kondensierten Anteils des Chromatins der NORs an den Positionen Ap2, Iq3 und Kq2. Chromosom B zeigte ein schwaches Signal auf den Verdichtungen des telomerischen Heterochromatins am Ende des kurzen Armes (Bter) und ein stärkeres Signal im Bereich der starken DAPI-Bande Bq21.

Abbildung 14: FISH-Signale (in Gelb/Grün, mit Pfeilspitzen markiert) der drei Dinukleotid-Motive (AT)8, (AG)8 und (CA)8 auf Polytänchromosomen von Phaseolus coccineus. Die Chromosomen wurden mit DAPI gefärbt und sind hier in Grau bzw. Rot dargestellt. (a) (AT)8-Signale auf Chromosomen A, B und H. (b) Loci von (AG)8 auf den Chromosomen A, B, C und K. Ein Teil des langen Armes ist präparationsbedingt nach unten geklappt. (c) Signale von (CA)8 auf dem kondensierten Teil der NORs der drei Chromosomen A, I und K. Im Bild links handelt es sich um einen Sammelnukleolus von dem ein Teil der Chromosomen abgerissen sind. Nur jeweils die Blöcke des kondensierten Chromatinanteils der NOR sind deutlich zu erkennen. Das Bild ganz rechts zeigt zwei (CA)8-Loci auf Chromosom B. Maßstab entspricht 10 µm
(AAT)5
Die Hybridisierungen mit (AAT)5 zeigten auf den Chromosomen A und B insgesamt drei Signale (Abbildung 15a). Auf Chromosom A kamen zwei unterschiedlich starke Signale vor. Das schwächere Signal lag im mittleren und das stärkere Signal im distalen Segment des großen Euchromatinbereiches an den Positionen Aq21.2' bzw. Aq21.3'. Der Locus auf Chromosom B war im Bereich der starken DAPI-Bande bei Bq21 lokalisiert.
(AAG)5
Bei Verwendung von (AAG)5 als Sonde wiesen die vier Chromosomen A, B, I und K zusammen sechs Hybrisierungssignale auf (Abbildung 15b). Chromosom A trug ein relativ schwaches subterminales Signal im langen Armes an Position Aq32. Auf Chromosom B waren insgesamt drei Loci zu beobachten. Ein sehr starkes Signal im Bereich der starken DAPI-Bande Bq21 und zwei jeweils in den proximalen Euchromatinbereichen des kurzen und langen Armes an den Positionen Bp21.1' und Bq31.1'. Auf Chromosom I lag ein sehr schwaches Signal am distalen Rand des cHC im kurzen Arm bei Position Ip22. Chromosom K wies einen Locus im cHC an Position Kq22, direkt unterhalb der starken DAPI-Bande auf.
(CAC)5
Signale von (CAC)5 fanden sich auf den drei NO-Chromosomen A, I und K an insgesamt drei Loci (Abbildung 15c). Die Fluoreszenzsignale lagen bei den drei Chromosomen jeweils im dichten Chromatin der NORs an den Positionen Ap2, Iq3 und Kp2.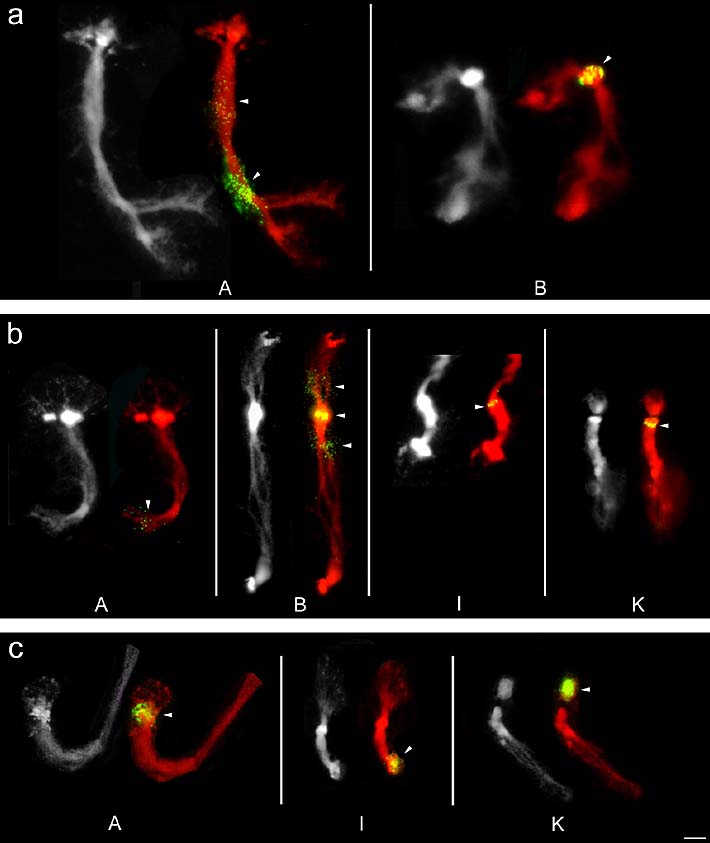
Abbildung 15: FISH-Signale (in Gelb/Grün, mit Pfeilspitzen markiert) der drei Trinukleotid-Motive (AAT)5, (AAG)5 und (CAC)5 auf Polytänchromosomen von Phaseolus coccineus. Die Chromosomen wurden mit DAPI gefärbt und sind hier in Grau bzw. Rot dargestellt. (a) (AAT)5-Signale auf den Chromosomen A und B. (b) Loci von (AAG)5 auf den vier Chromosomen A, B, I und K. (c) Signale von (CAC)5 auf den drei NO-Chromosomen A, I und K jeweils im kondensierten Chromatinbereich der NORs. Maßstab entspricht 10 µm.
(AATG)4
Die Hybridisierung mit dem Motiv (AATG)4 ergab Signale im cHC aller Chromosomen und im Bereich von dichtem nukleolären Chromatin (Abbildung 16a). Zusätzlich traten noch Signale im Übergangsbereich vom cHC zu den euchromatischen Bereichen auf, die allerdings sehr viel schwächer waren und sehr unregelmäßig auftraten, weshalb sie hier keine Berücksichtigung fanden.
(GATA)4
Die Sonde (GATA)4 zeigte auf den beiden Chromosomen A und B zusammen drei Signale (Abbildung 16b). Auf Chromosom A waren zwei Loci zu beobachten, die beide in dem großen euchromatischen Teil des langen Armes lagen. Ein Locus befand sich im proximalen Segment an Position Aq21.1' und der zweite im distalen Segment an Position Aq21.3. Chromosom B wies nur einen Locus im cHC im Bereich der starken DAPI-Bande Bq21 auf. Zuweilen war die Signalintensität des Bq21-Locus nur schwach ausgeprägt. Bei der direkten Detektion mit FITC-(GATA)4 als Sonde war er jedoch immer nachweisbar.
(GACA)4
Die zwei Signale von (GACA)4 lagen ebenfalls ausschließlich auf den Chromosom A und B (Abbildung 16c). Die Verteilung dieser beiden Hybridisierungssignale weist große Ähnlichkeit zu den Loci von (GACA)4 auf. Allerdings war auf Chromosom A immer nur ein (GACA)4-Locus im distalen Segment an Position Aq21.3' zu beobachten. Auf Chromosom B hingegen befand sich der (GACA)4-Locus ebenfalls im Bereich der starken DAPI-Bande an Position Bq21.
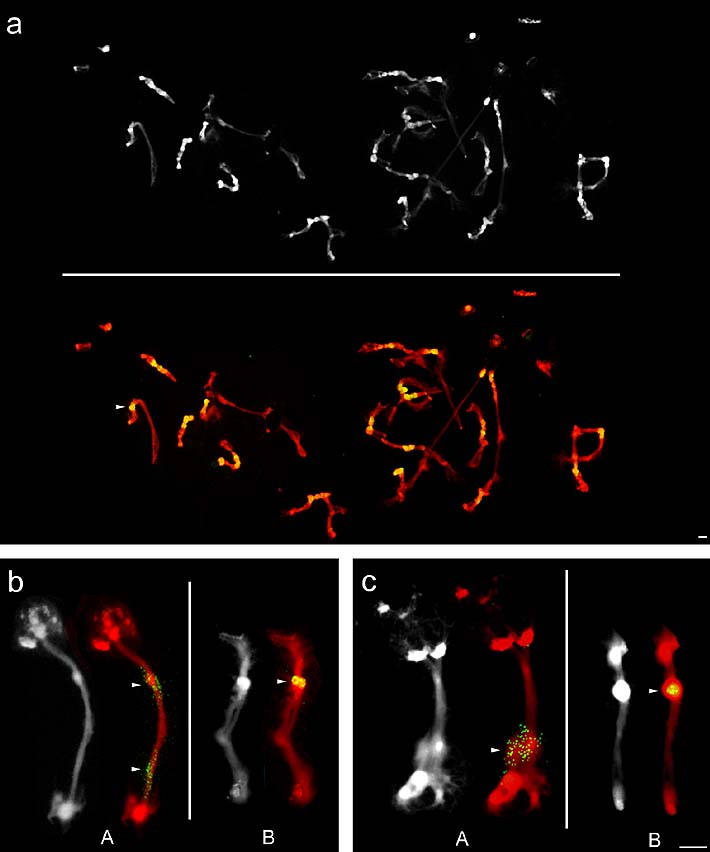
Abbildung 16: FISH-Signale (in Gelb/Grün, mit Pfeilspitzen markiert) der drei Tetranukleotid-Motive (AATG)4, (GATA)4 und (GACA)4 auf Polytänchromosomen von Phaseolus coccineus. Die Chromosomen wurden mit DAPI gefärbt und sind hier in Grau bzw. Rot dargestellt. (a) Unvollständiger Kern mit Signalen von (AATG)4 auf allen Chromosomen im Bereich des cHCs und dem dichten Chromatin der NORs. (b) (GATA)4-Signale auf Chromosom A und B. (c) Signale der (GACA)4-Sonde auf den Chromosomen A und B. Maßstab entspricht 10 µm.
Die Hybridisierungen mit den Sonden der beiden 16 Nukleotid langen GC-reichen Motive (C)16 und (GC)8 ergaben unter den berechneten Hybridisierungstemperaturen von 59°C keine Signale. Diese Sonden wurden daher zusätzlich unter weniger stringenten Bedingungen bei 40°C und 50°C hybridisiert und gewaschen. Die Sonde des Mononukleotid-Motiv (C)16 wurde darüber hinaus auch als getailtes Oligonukleotid eingesetzt, um Signale höherer Fluoreszenzintensität zu erhalten.
(C)16
Bei Verwendung der 5'-endmarkierten (C)16-Sonde wurden auf den Chromosomen A, B, I insgesamt vier Signale beobachtet (Abbildung 17a). Die getailte (C)16-Sonde zeigte weitere vier Signale auf den Chromosomen J und H (Abbildung 17b). Auf Chromosom A lag ein Signal am Ende des langen Armes im euchromatischen Bereich an Position Aq32 (Abbildung 17a). Chromosom B wies jeweils zwei Loci in den proximalen Segmenten der euchromatischen Bereiche an den Positionen Bp21.1' und Bq31.1' auf. Chromosom I zeigte ebenfalls ein Signal in einem proximalen, euchromatischen Segment an Position Ip31.
Auf den Chromosomen H und J waren jeweils zwei Signale im Bereich des cHC zu beobachten (Abbildung 17b). Auf Chromosom H deckte ein Signal das gesamte cHC des kurzen Armes inklusive des Centromers ab (Hp11-12 und Hq11), während das zweite Signal auf den distalen Teil des cHC des langen Armes beschränkt war (Hq22-24). Der Bereich der hellen DAPI-Bande blieb jedoch vom Signal ausgespart. Die Signalverteilung auf Chromosom J war der von Chromosom H ähnlich. Die Signale lagen ebenfalls auf den beiden Armen jeweils im distalen Teil des cHC. Die Positionen der beiden Signale sind Jp22-24 und Jq22-23. Wie schon bei Chromosom H war die Aussparung des Centromers und der DAPI-Bande, hier sowohl im kurzen und langen Arm, sehr augenfällig.
(GC)8
Bei Einsatz von (GC)8 war nur auf Chromosom K ein eindeutiges Signal (Abbildung 17c) zu beobachten. Der Locus lag terminal auf dem langen Arm an Position Kq31.3'.
(GCC)5
Die Hybridisierung mit (GCC)5 bei 50°C und 55°C ergab auf den vier Chromosomen A, B, C und K insgesamt sechs Loci (Abbildung 17d). Auf Chromosom A fand sich ein Signal in dem stärker kondensierten Euchromatinbereich an Position Aq31. Chromosom B zeigte einen Locus im Euchromatin des kurzen Armes an Position Bp21.2' und einen zweiten im Bereich der starken DAPI-Bande bei Bq21. Auf Chromosom C lagen die beiden Signale in den zwei Blöcken des cHC an den Position Cp12 und Cq21-22. Das (GCC)5-Signal auf Chromosom K wurde ebenfalls im cHC direkt unterhalb der starken DAPI-Bande an Position Kq22 lokalisert.
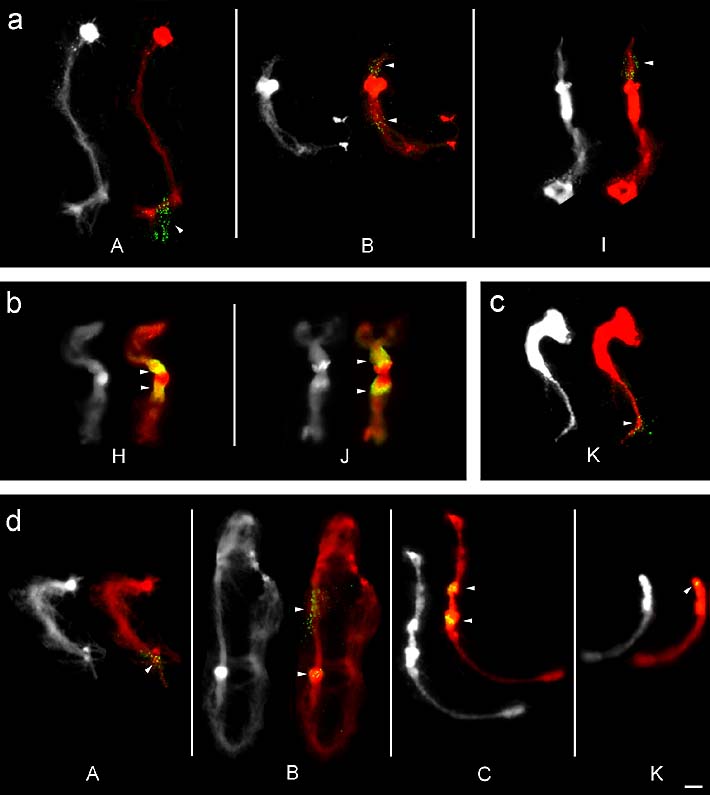
Abbildung 17: FISH-Signale (in Gelb/Grün, mit Pfeilspitzen markiert) der GC-reichen Motive (C)16, (GC)8 und (GCC)5 auf Polytänchromosomen von Phaseolus coccineus Die Chromosomen wurden mit DAPI gefärbt und sind hier in Grau bzw. Rot dargestellt. (a) Signale der 5'-endmarkierten (C)16-Sonde, hybridisiert bei 50°C, auf den Chromosomen A, B und I. (b) Signale der getailten (C)16-Sonde auf Chromosom H und J. (c) (GC)8-Signal im Euchromatin von Chromosom K. (d) Signale von (GCC)5, hybridisiert bei 50°C und 55°C, auf den Chromosomen A, B, C und K. Maßstab entspricht 10 µm.




