




2.2 Chromosomenpräparation
Die etablierte Methode zur Präparation der Polytänchromosomen aus
dem Embryosuspensor von Phaseolus coccineus (Schumann et al. 1990; Nenno
1992; Nenno et al. 1994; Nagl 1996) wurde in einigen Details weiterentwickelt,
um die Chromosomen besser zu spreiten.
Dazu war es notwendig, jeden einzelnen Zellkern, vor dem Spreiten der
Chromosomen aus der Zelle, freizulegen und einer zusätzlichen Mazeration
in Essigsäure zu unterziehen. Ferner wurde der erste
Wässerungsschritt des fixierten Materials sowie alle anschließenden
zeitlich deutlich ausgedehnt.
Die Beschichtung der Objektträger mit Poly-L-Lysin erfolgte nach der
Methode von Huang et al. (1983).
Material, Chemikalien und Lösungen
Kälteplatte (FTS Systems)
Stereomikroskop mit Durchlicht, 0,8-6,4fach, STEMI SV8 (Zeiss) und
Phasenkontrast-Mikroskop (Zeiss)
MES (2[N-Morpholino] ethanesulfonic acid) (Sigma, M-3023)
Poly-L-Lysin(Mw 300.000, Sigma, P-1524)-Lösung, 1 mg/ml in Aqua
dest.
Sucrose (SERVA, 35580)
Pektinase (Fluka, 76290)
Propionsäure, 99.5%
Milchsäure, DL-Lactic acid (Serva)
MES-Sucrose-Puffer: 25 mM MES mit 6% (w/v) Sucrose, pH 5,5
Pektinase-Gemisch: 10% (w/v) Pektinase in MES-Sucrose-Puffer
Durchführung
Vorbereitung
- um 6-8 Präparate herzustellen, werden die Suspensoren von ca. 60-80
Samen benötigt
- fixierte und bei -20°C aufbewahrte Samen in 70% Ethanol (RT)
überführen und auf RT bringen
- Ethanol durch mehrmaliges Mischen der Lösung mit Aqua dest. im
Verhältnis 50:50 auswaschen, bis die Samen beim Schütteln keine
Schlieren mehr ziehen und sich am Boden absetzen
- unter dem Stereomikroskop die Samenschale mit einem
Oberflächenschnitt von der Mitte des Samens in Richtung Mikropyle bis zur
äußeren Samenschale hin öffnen
- den Embryosuspensor mit möglichst wenig umliegendem Gewebe - im
folgenden als "Gewebestück" bezeichnet - herauspräparieren (siehe
Abbildung)
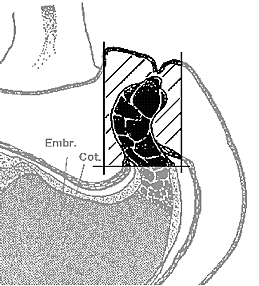
- Gewebestücke sammeln, 2 mal in Aqua dest. spülen und über
Nacht bei +4°C aufbewahren
Enzymatische Mazeration
- aus den Gewebestücken letzte Reste von Ethanol mit Aqua dest.
herausspülen
- enzymatische Mazeration der Gewebestücke in 20 ml 10%
Pektinase-Lösung für 3 h bei 37°C in einem
Inkubationsschüttler bei 120 rpm
- nach dreimaligem Waschen in Aqua dest. die Gewebestücke für 3 h
in 10 ml Propionsäure-Milchsäure-Gemisch (1:1) bei RT nachfixieren
- Fixiergemisch durch mehrmaliges Ersetzen von jeweils der Hälfte der
Lösung durch Aqua dest. auswaschen, bis die Gewebestücke beim
Schütteln keine Schlieren mehr ziehen
- Gewebestücke für weitere 24 h bei +4°C
aufbewahren
Chromosomenpräparation
- mehrere Gewebestücke in einen großen Tropfen 45%
Essigsäure auf einen Hohlschliff-OT überführen und die
Suspensorzellen vereinzeln
- nur die größten Suspensorzellen mit sehr klarem Cyto- und
Nukleoplasma und nicht zu stark kondensierten Chromosomen aussortieren
- 10-20 Zellen mit einer 20 µl-Pipette (mit abgeschnittener Spitze) in
einem Tropfen 45% Essigsäure auf einen weiteren Hohlschliff-OT
überführen
- Jede einzelne Zelle zunächst durch behutsames
Drücken mit Präpariernadel und Pinzette öffnen, wobei ihr Inhalt
langsam herausquillt. Durch erneutes vorsichtiges Drücken den
Inhalt von der Zellwand befreien (Abbildung unten). Nach der Größe
des Bereiches zu schließen, den die Chromosomen in dem herausgequetschten
Zellinhalt ausmachen, besteht er zum überwiegenden Teil aus dem
Zellkern.
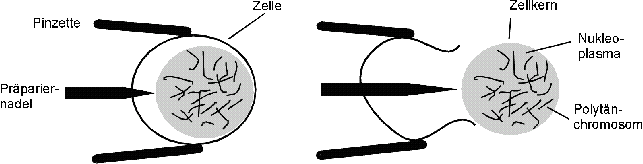
- Zellkern, auf einen weiteren Hohlschliff-OT in einen großen Tropfen
45% Essigsäure übertragen und weitere (ca. 12) solcher Zellkerne
darin sammeln
- Die Kerne 15 bis 20 min in der Essigsäure mazerieren, um das viskose
und gallertartige Nukleoplasma etwas aufzulösen bzw. flüssiger zu
machen
- die Kerne auf einen Poly-Lysin-beschichteten OT übertragen, ein DG
aufgelegen und mit einem Stück Filterpapier abdecken
- die Zellkerne mit der Rückseite einer Präpariernadel durch
leichtes Klopfen leicht quetschen, was zu einer Vereinzelung der Chromosomen
führt
- Qualität der Präparation im Phasenkontrast (40x) kontrollieren
- das Präparat auf einer Kälteplatte bei -70°C einfrieren und
das DG anschließend mit einer Rasierklinge gemäß der
Trockeneis-Methode nach Conger und Fairchild (1953) "absprengen"
- Präparate in 99% Ethanol entwässern und über Nacht an der
Luft trocknen
Die Abbildung zeigt einen OT vor schwarzem Hintergrund, auf
dem 12 gequetschte "Zellkerne" zu erkennen sind

- Präparate sollen vor dem weiteren Gebrauch mindestens 3 bis 4 Tage
bei RT lagern


















