




Der bisherige Weg zur Identifizierung der Polytänchromosomen führte über das Muster der Verteilung von Eu- und Heterochromatin, und insbesondere der Verteilung der interkalaren (heterochromatischen) Querbanden (Nagl 1962b; Nagl 1967). Doch dieses Querbandenmuster erwies sich nicht immer als zuverlässig auftretendes Merkmal (vgl. Nagl 1965; Nagl 1967) und eignete sich nur unzureichend zur eindeutigen Identifizierung (Schweizer und Ambros 1979). Vor diesem Hintergrund erscheint es nicht abwegig, daß zwischen Polytänchromosomen, die als homolog angesehen wurden, erhebliche Unterschiede festgestellt wurden (Cionini et al. 1982). Es kann somit angenommen werden, daß in der zurückliegenden Literatur durchaus Verwechslungen bei der Identifizierung stattfanden.
Die Längenvariation der Polytänchromosomen ist auf die präparativ bedingte Streckung zurückzuführen und muß daher als Artefakt angesehen werden. Nach eigenen Beobachtungen sind davon insbesondere die euchromatischen Bereiche betroffen, die aufgrund der Dehnung eine Verjüngung zeigen. Darüber hinaus sind prinzipiell Variationen durch verschiedene Polyploidiegrade oder unterschiedliche Kondensationsgrade des Euchromatins möglich (Nagl 1974). Diese beiden letztgenannten Einflüße lassen sich aber durch Aussortieren der geeigneten Suspensorzellen vor der Präparation erheblich reduzieren. Die Größe der Chromosomen und entsprechend auch ihr Polyploidiegrad ist direkt erkenn- bzw. abschätzbar und besonders stark kondensierte Chromosomen fallen durch ihre dunkle Färbung auf.
Im Vergleich zu den oben genannten variablen Merkmalen der Polytänchromosomen zeigte sich der Bereich des centromernahen Heterochromatin (cHC) in der vorliegenden Arbeit als nahezu konstant. Er wurde hier erstmals eingehend untersucht. Heterochromatin spielt bei Karyotypisierung oft eine wichtige Rolle, wobei allerdings nur die konstant auftretenden Bereiche berücksichtigt werden sollten (Joachimiak et al. 1997).
Der Bereich des cHC ist bei Phaseolus-Polytänchromosomen nicht homogen, sondern läßt verschiedene morphologische Merkmale erkennen. Diese sind teilweise bereits im Phasenkontrast erkennbar, in ihrer Gesamtheit jedoch erst in der DAPI-Fluoreszenz zu beobachten. Neben seiner Ausdehnung umfassen die Merkmale des cHC (1) die centromerische Einschnürung, (2) Segmente, die nach Protease-Vorbehandlung durch starke DAPI-Fluoreszenz auffallen (starke DAPI-Bande), (3) sekundäre Einschnürungen die nicht der NOR zuzuordnen sind sowie (4) Segmente, die geringfügig breiter sind als die sonstige Breite des Chromosoms (vgl. Abbildung 6).
Auf jedem der elf Polytänchromosomen stellen sich diese vier Merkmale unterschiedlich dar und erlauben eine Identifizierung der Chromosomen. Dabei weist nicht jedes cHC alle Merkmale auf. Das Centromer ist sicherlich bei allen Chromosomen vorhanden, aber nicht immer deutlich erkennbar. Starke DAPI-Banden treten bei allen Chromosomen auf, allerdings mit unterschiedlicher Intensität, und zwei Chromosomen besitzen eine zusätzliche, schwächere DAPI-Bande. Sekundäre Einschnürungen und verbreiterte Segmente treten jedoch nur bei einigen Chromosomen und unabhängig voneinander auf. Das chromosomenspezifische Muster der Ausprägung der Merkmale des cHC bleibt auch im gestreckten Zustand erkennbar. Die centromerische Einschnürung mancher Chromosomen ist ohne Streckung fast nicht erkennbar. Chromosomen mit besonders markanten cHC-Bereichen lassen sich selbst in Kernen identifizieren, die nicht alle 22 Chromosomen enthalten. Dies kann eine große Hilfe darstellen, da selbst die hier vorgestellte, verbesserte Präparation nur selten vollständige Kerne liefert.
Während drei der vier charakteristischen Merkmale des cHC bereits im Phasenkontrast erkennbar sind, treten die starken DAPI-Banden erst nach der Vorbehandlung mit Pepsin/HCl und RNase hervor. Dies könnte ein Hinweis darauf sein, daß ein Teil der DNA durch die Einwirkung von Pepsin/HCl zwar im gesamten Chromatin herausgelöst wird, die Bereiche der starken DAPI-Banden aber von dieser Extraktion weniger stark betroffen sind und sich deshalb anschließend mit DAPI stärker anfärben lassen. Damit würde der Mechanismus dieser DAPI-Färbung nach Vorbehandlung mit Pepsin/HCl und RNase sowohl Aspekte der C-Bänderung (Extraktion von DNA) als auch der G-Bänderung (Protease-Behandlung) (Sumner 1990) beinhalten. Aber auch der Einfluß der größeren Bindungspräferenz von DAPI für AT-reiche Sequenzen (Lin et al. 1977) könnte eine Rolle spielen.
Die Präparate wurden zum Teil mit DAPI und Propidiumiodid (DAPI/PI) gefärbt und im Filter für DAPI-Fluoreszenz unter UV-Anregung (etwa 350-370 nm) betrachtet. Dabei fiel ein Muster aus blauen, rosafarbenen und weißlichen Segmenten auf, welches die Erkennung verschiedener Chromosomenabschnitte wesentlich erleichterte (vgl. Abbildung 7). Die blaue bis weißliche Fluoreszenz stammt von DAPI. Die rosafarbene Fluoreszenz hingegen wurde mit hoher Wahrscheinlichkeit von PI alleine bzw. durch Überlagerung mit der blauen/weißlichen Fluoreszenz von DAPI hervorgerufen.
Eine mögliche Erklärung dafür, daß Chromosomenabschnitte nach PI-Färbung nicht nur bei der üblicherweise verwendeten Grün-Anregung (530 nm) sondern auch bei UV-Anregung (350-370 nm) eine rote Fluoreszenz ziegen, findet sich bei Klett (1992). Nach Klett läßt sich PI über das gesamte Spektrum zwischen 220 bis 266 nm zur Fluoreszenz anregen und zeigt bei 282 und 515 nm zwei Maxima. Doch gerade im UV-Bereich bei 360 nm, der normalerweise für die DAPI-Anregung verwendet wird, weist PI ein Anregungs-Minimum auf. Gibt man jedoch zu PI-gefärbten Zellen DAPI in gleicher Menge hinzu, verzehnfacht sich die rote Fluoreszenz durch Energietransfer von DAPI zu PI. Für den umgekehrten Fall, der Zugabe von PI zu DAPI-gefärbten Zellen, beschreibt Klett einen Verlust der DAPI-Fluoreszenz, den er auf die Konformationsänderung der DNA durch interkalierendes PI zurückführt. Mit diesen Ergebnissen ließe sich erklären, daß (1) die PI-Färbung im DAPI-Filter erst durch Zugabe von DAPI in verstärktem Maße sichtbar wird und (2) die DAPI-Fluoreszenz durch PI abgeschwächt wird. Letzteres scheint aber nur für die euchromatischen Chromatinbereiche zu gelten die erheblich dunkler erscheinen als die starken und hellen DAPI-Banden im cHC. Für die Betrachtung der DAPI/PI-Färbung ist es aber ebenso wichtig, einen DAPI-Langpaßfilter zu verwenden, da nur damit alle Wellenlängen des Spektrums vom blauen bis zum roten Licht durchgelassen werden.
Eine Differenzierung des cHC der Polytänchromosomen war Schweizer (1976b) bereits bei der differentiellen Fluorochrom-Bänderung mit DAPI und Chromomycin A3 (CMA) aufgefallen. Hieraus wurde geschlossen, daß sich das cHC in eine Fraktion mit höherem Anteil an AT-reichen und in eine zweite Fraktion mit überwiegendem Anteil von GC-reichen Sequenzen unterteilen läßt. In der entsprechenden Arbeit wird diese Verteilung nur für eines der NO-Chromosomen beispielhaft gezeigt. Der Vergleich zwischen dem von Schweizer (1976b, Fig. 5) dargestellten Chromosom mit dem neuen Idiogramm (s. Abbildung 12) läßt vermuten, daß es sich dabei um Chromosom I handelt. Unter dieser Voraussetzung würde eine markante Ähnlichkeit zwischen beiden Färbungen vorliegen. Die von Schweizer mit CMA- AMD/DAPI+ gekennzeichneten Bereiche (AT-reich) stimmen in ihrer Lage den weißen Segmenten der DAPI/PI-Färbung überein. Ebenso entsprechen die mit CMA+ AMD/DAPI- (GC-reich) gekennzeichneten Bereiche den rosafarbenen Segmenten der DAPI/PI-Färbung.
Bei Anwendung konventioneller Bänderungstechniken wie z. B. Giemsa-C-Bänderung zeigen Polytänchromosomen von Phaseolus C-Banden in verschiedenen Chromosomenabschnitten. Große und starke Banden fanden sich im cHC sowie in der NOR, und kleinere im Bereich des telomerischen Heterochromatins sowie auf manchen interstitiellen Abschnitten (Schweizer 1976b; Schweizer und Ambros 1979). Eine Detailaufnahme eines C-gebänderten Polytänchromosoms, das sich zum Vergleich mit den vorliegenden Ergebnissen eignet, findet sich bei Schweizer und Ambros (1979) in Fig. 6c. Diese Abbildung zeigt zwei NO-Chromosomen, von denen das als "Na" bezeichnete Chromosom mehrere, unterschiedlich starke C-Banden aufweist. Der Vergleich des C-gebänderten Chromosoms Na mit dem DAPI- bzw. DAPI/PI-gefärbten Chromosom K läßt eine markante Übereinstimmung erkennen. Die Banden 1 und 3 des "Na-Chromosoms" stimmen in ihrer Lage mit der starken DAPI-Bande und der zweiten, schwächeren DAPI-Bande überein. Dieses Beispiel scheint anzudeuten, daß eine prinzipielle Korrelation zwischen der hier vorgestellten Fluorochrombänderung und der C-Bänderung besteht.
Die Bänderung mit Fluorochromen ist allgemein für die Karyotypisierung besonders geeignet wie zahlreiche Untersuchungen zeigen (z. B. Sheikh und Kondo 1995; Moscone et al. 1996; Xirau und Siljak-Yakovlev 1997). Fluoreszenzfarbstoffe weisen eine hohe Sensitivität auf und bieten die Möglichkeit, bei geeigneter Auswahl unterschiedliche Basenzusammensetzungen kenntlich zu machen (Joachimiak et al. 1997).
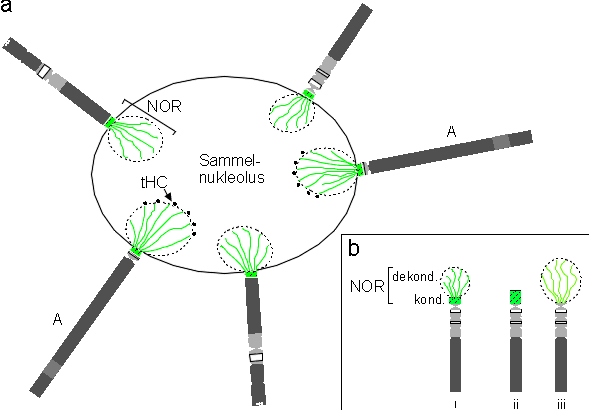
Die Beobachtung, daß sich die Nukleolus-organisierende Chromosomen (NO-Chromosomen) bei Phaseolus coccineus an der Ausbildung eines oder mehrerer sog. Sammelnukleolus bzw. -nukleoli beteiligen (Nagl 1967), wurde auch in dieser Arbeit regelmäßig bestätigt.
Die Anzahl der Polytänchromosomen mit einer NOR war ursprünglich mit zwei Paaren angenommen worden (Nagl 1965). Doch wies Nagl bereits bei der Erstbeschreibung der NO-Chromosomen darauf hin, daß in den höher endopolyploiden Endospermkernen drei Paare von SAT-Chromosomenbündeln vorliegen. Die Ergebnisse aus der ISH mit einer 3H-markierter ribosomaler RNA (Avanzi et al. 1972) und frühe Versuche mit Giemsa-C-Bänderung (Schweizer 1976b) lieferten weitere Hinweise, daß die tatsächliche Zahl von NO-Chromosomen drei betragen müßte. Bestätigt wurde die Zahl von drei NO-Chromosomen durch die statistische Absicherung von Giemsa-C-Bänderungen (Schweizer und Ambros 1979) und FISH (Nenno et al. 1994).
Die anfängliche Beobachtung von nur zwei NO-Chromosomen ist nach Schweizer und Ambros (1979) eine Fehlinterpretation. Bei der Anfertigung der Quetschpräparate reißen oftmals NO-Chromosomen von dem einen (oder mehreren) Sammelnukleolus ab (Avanzi et al. 1972; Brady und Clutter 1972; Schweizer und Ambros 1979), und nur ihre heterochromatisch erscheinenden Bereiche bleiben am Nukleolus hängen. Diese Blöcke wurden bei der Erstbeschreibung irrtümlich als "Endosatelliten" interpretiert. Die zwischen "Endosatellit/-trabant" und dem vermeintlich zugehörigen Chromosom liegende NOR wurde als "SAT-Zone" angenommen, und die gesamte Konstellation als "SAT-Chromosom" angesehen. Ein weiterer Hinweis für die Annahme von "SAT-Chromosomen", war die gelegentliche Beobachtung von fädigen Strukturen der NOR, die das Chromosom mit dem "Satellit" als "Brücke" durchgängig verbinden würden (1965; Nagl 1974, Schema in Fig. 29). Diese Durchgängkeit konnte aber von den Ergebnissen der Giemsa-C-Bänderung nicht bestätigt werden. Vielmehr zeigte sich daß jede NOR einen eigenen Bereich abgrenzte (Schweizer und Ambros 1979). Diese Ergebnisse wurden kurze Zeit später in einem "modifizierten vorläufigen Idiogramm" berücksichtigt, welches nicht mehr zwei, sondern drei NO-Chromosomen zeigt und keine Satelliten mehr ausweist (Schumann et al. 1990).
Aus heutiger Sicht handelt es sich bei den Chromatinblöcken, die als "Endosatelliten" interpretiert wurden, mit hoher Wahrscheinlichkeit um den kondensierten Chromatinbereich der NOR, der nahezu vollständig den kurzen Arm von Chromosom K ausmacht. Inbesondere Chromosom K reißt sehr häufig im Centromerbereich auseinander, und nur der kurze Arm bleibt am Nukleolus hängen. Sofern in früheren Arbeiten mehr als zwei "Endosatelliten" beoachtet wurden, handelte es möglicherweise um den kondensierten Chromatinanteil des NOR von Chromosom I, nicht aber um den von Chromosom A. Letzteres Chromosom blieb während der vorliegenden Untersuchungen in der Regel immer vollständig am Sammelnukleolus bzw. -nukleoli erhalten.
Das Schema in Abbildung 21 faßt die Ergebnisse aus der vorliegenden Arbeit zur Struktur des Sammelnukleolus und den NO-Chromosomen zusammen. Es ist eine Kombination der Beobachtungen im Phasenkontrast, nach DAPI-Bänderung sowie der FISH mit rDNA- und Telomer-Sonde. Nach diesem Modell ragt bei Polytänchromosomen, die sich an einem Sammelnukleolus beteiligen, nur der dekondensierte Anteil des Chromatins der NOR in den Nukleolus hinein. Auf jener Seite der aufgelockerten NOR, die dem Zentrum des Sammelnukleolus zugewandt ist, befindet sich das telomerische Heterochromatin (tHC) in Form von punktförmigen Verdichtungen. Am häufigsten trifft man das tHC bei Chromosom A an, wohingegen man es bei den anderen beiden NO-Chromosomenpaaren nur dann erkennt, wenn die NOR bei der Präparation gedehnt wurde. Der kondensierte Chromatinanteil der NOR befindet sich hingegen an der Peripherie bzw. außerhalb des Nukleolus (vgl. Abbildung 8). Eine ähnliche Verteilung der 18S-25S rDNA in kondensierten wie auch dekondensierten Bereichen der NOR wurde in Interphasekernen von Zea mays und Secale cereale beobachtet (Givens und Phillips 1976; Leitch et al. 1992).

Abbildung 20: Schematisches Modell einiger Zusammenhänge zwischen Nukleolus und den polytänen NO-Chromosomen von Phaseolus coccineus. (a) Beispiel von Polytänchromosomen die gemeinsam einen Sammelnukleolus bilden, in den jeweils das dekondensierte Chromatin der NOR hineinragt. Der kondensierte Chromatin-Anteil der NOR liegt am Rande bzw. außerhalb des Sammelnukleolus. Die terminal am NOR liegenden, punktförmigen Verdichtungen des tHC befinden sich vermutlich nicht - wie es den Anschein hat - in, sondern auf dem Sammelnukleolus. Am häufigsten ist das tHC an der NOR bei Chromosom A zu erkennen. (b) Verschiedene Kondensationszustände der NOR (i - iii) und die entsprechende Signalverteilung der 18S-25S rDNA-Sonde. (i) Auf dem dekondensierten Chromatinanteil der NOR (dekond.), besteht das Signal nur aus Signalpunkten, die wie "Perlen an einer Kette" aufgereiht erscheinen (hier als Linie). Auf dem kondensierten Chromatinanteil der NOR (kond.) zeigt die Sonde ein starkes Signal aus vermutlich vielen dicht liegenden Signalpunkten. Teilabbildungen (ii) und (iii) stellen extreme und selten auftretende Kondensationzustände der NOR dar: (ii) NOR ist vollständig kondensiert bzw. (iii) NOR ist völlig dekondensiert. Beispiele für (ii) und (iii) finden sich bei (Nenno et al. 1994).
Die Verwendung des Begriffes "Nukleolus-assoziiertes Heterochromatin" für die beiden unterschiedlich stark kondensierten Bereiche der NOR (Nagl 1965; Nagl 1981) scheint aus heutiger Sicht nicht angebracht. Heterochromatin ist nach Heitz (1928) der Anteil des Chromatins, der der Kondensations- und Dekondensations-Phase der typischen mitotischen Zellteilung nicht folgt, sondern immer kondensiert bleibt. Wie aber vor kurzem gezeigt werden konnte, bleibt das kondensierte Chromatin der NOR bei den Polytänchromosomen von P. coccineus nicht immer kondensiert, sondern kann auch dekondensiert vorliegen (vgl. Schema in Abbildung 20b und Nenno et al. 1994, Fig. 3a/b und 4a/b). Meist ist jedoch ein Teil der NOR kondensiert und der andere Teil aufgelockert. Um diese beiden Zustände zu symbolisieren, wurde die NOR im Idiogramm zur Hälfte hell und zur Hälfte dunkel gezeichnet (vgl. Abbildung 12). Es bietet sich an, für die beiden Kondensationszustände des Chromatins der NOR treffendere Begriffe einzuführen. Ein Vorschlag wäre "dichtes nukleoläres Chromatin" (DNC, dense nucleolar chromatin) und "lockeres nukleoläres Chromatin" (LNC, loose nucleolar chromatin).
Durch Vergleich von NO-Chromosomen aus ausgewählten Abbildungen in der Literatur mit dem neuen Idiogramm soll im folgenden versucht werden, eine Korrelation zwischen der alten und neuen Benennung der NO-Chromosomen herzustellen. Die Fotos der Chromosomen I (=S1) und V (=S2) in der ersten detaillierten Beschreibung (Nagl 1965) erlauben keine eindeutige Zuordnung. Von Chromosom S1 wird nur ein Foto des sog. Endosatelliten photographisch dokumentiert. Ansonsten wird auf eine schematische Darstellung verwiesen. Vergleicht man das dortige Idiogramm (Fig. 1d) mit dem heutigen Idiogramm (vgl. Abbildung 12), so ähneln die ursprünglich jeweils als I und V bezeichneten Chromosomen am meisten den hier als A bzw. K und I bezeichneten Chromosomen.
Von den von Schweizer und Ambros (1979) mit Na, Nb und Nc bezeichneten NO-Chromosomen wird nur das Na-Chromosom photographisch hinreichend dokumentiert. Wie oben erwähnt, handelt es sich dabei mit hoher Wahrscheinlichkeit um das hier mit K bezeichnete Chromosom. Weitere Vergleiche von Chromosomen in Abbildungen aus früheren Arbeiten, auf denen sich die Polytänchromosomen aufgrund ausreichend guter Erhaltung neu identifizieren lassen, sind in Tabelle 12 zusammengefaßt. Daraus wird ersichtlich, daß es sich bei den früher als I klassifizierte Chromosomen in drei Fällen vermutlich um Chromosom K handelte. Für die beiden anderen NO-Chromosomen (II und V) ist kein entsprechend eindeutiger Vergleich möglich, da sich nur die Bilder aus einer Arbeit (Tagliasacchi et al. 1993) auswerten ließen.
Tabelle 12: Zuordnung zwischen der Benennung der NO-Chromosomen nach Nagl (1967) und der in dieser Arbeit neu erstellten.
| NO-Chromosomen | ||
|---|---|---|
| Referenz | Nagl 1967 | neu |
| Nagl 1970, Fig. 6 | I | K |
Durante et al. 1977, Fig. 5 und 6 |
I |
K |
Tagliasacchi et al. 1993, Fig. 3 und 4 |
I |
K |
Die hier beschriebenen punktförmigen Verdichtungen am Ende aller Chromosomen entsprechen in ihrer Größe und ihrem Vorkommen den von Nagl (1967) erstmals erwähnten "terminale Knöpfen". Schweizer (1976b) bezeichnete diese Strukturen nach C-Bänderung als "terminales Heterochromatin". Das terminale/telomerische Heterochromatin soll im folgenden daher mit "tHC" abgekürzt werden. Bereits Schweizer (1976b) hatte verschiedene Formen von Anhäufungen des tHC beschrieben, die von einer Scheibenform aus vielen dicht beieinanderliegenden Punkten bis hin zu zahlreichen einzelnen Punkten reichte, wie sie auch hier beobachtet wurden (vgl. Abbildung 9).
Nach DAPI-Färbung zeigte das tHC in der vorliegenden Arbeit keine besonders starke Fluoreszenz, war dennoch immer erkennbar. Nach Färbung mit DAPI/PI, zeigte sich allerdings in der Regel eine starke, rosa Fluoreszenz. Dies ähnelt den Ergebnissen der Fluorochrom-Bänderung von Schweizer (1976b), der im tHC eine stärkere Fluoreszenzintensität von CMA als von AMD/DAPI beschreibt.
Auch die NO-Chromosomen zeigen, wenn die terminal liegenden NORs stark aufgelockert oder gedehnt sind, Strukturen, die in Größe und Ausprägung dem tHC sehr ähnlich sind. Es soll hier aber nicht der Interpretation von Schweizer und Ambros (1979) gefolgt werden, die diese Strukturen als mögliche Satelliten angesehen haben. Vielmehr scheint es sich hier aufgrund der offensichtlichen Ähnlichkeit ebenfalls um tHC zu handeln (vgl. Abbildung 9).
Polytänchromosomen mit Querbänderungen (vgl. Abbildung 10) waren im Laufe dieser Arbeit gelegentlich in den Präparate zu beobachten. Die Bänderung trat nicht bei allen, sondern nur bei ein bis zwei Chromosomen eines Kerns auf. Es gibt Hinweise, daß das Auftreten der Bänderung mit der 4-7 tägigen Lagerung (+4°C) der Hülsen vor der Fixierung in Zusammenhang steht. Daß sich durch kühle Temperaturen während der Anzucht der Pflanzen eine Querbänderung bei Polytänchromosomen von P. vulgaris induzieren läßt, wurde bereits von Nagl (1969a) beschrieben.
Hinweise auf die vielsträngige Längstruktur der Polytänchromosomen, die den Chromatiden oder Bündeln von Chromatiden entsprechen, fanden sich auch an Feulgen-gefärbten Polytänchromosomen von Phaseolus coccineus (Brady und Clutter 1974). Sichtbar sind die Längsstruktur in den Präparationen aber immer nur in Chromosomenbereichen, deren Chromatin ungewöhnlich stark aufgelockert ist (vgl. Abbildung 10).




